İçindekiler
IHC Nedir?
İmmünohistokimya, doku kesitlerindeki antijenlerin dağılımını ve lokalizasyonunu görselleştirmek için güçlü bir araçtır.
İmmünohistokimya (IHC), doku kesitlerindeki proteinlerin ve diğer antijenlerin yerini saptamak için antikorlar kullanır. Antikorlar oldukça spesifik olduklarından, antikor yalnızca ilgili antijene bağlanacaktır. Antikor-antijen etkileşimi daha sonra renkli bir enzim substratı (kromojenik tespit) veya floresan bir boya (floresan tespiti) kullanılarak görüntülenir.
IHC, western blot veya ELISA’dan daha az kantitatif olmasına rağmen, protein lokalizasyonu hakkında değerli bilgiler verir. Protein ekspresyon modelleri araştırma ve sağlık hizmetlerinde son derece faydalıdır ve kanser gibi hastalıklarda anormal hücreleri belirlemek için önemli bir tanı aracı olabilir.
Numune hazırlama
Numune hazırlama, immünohistokimya (IHC) süresince yüksek kaliteli boyama elde etmek için oldukça önemlidir.
IHC için numune hazırlama, fiksasyon, dehidrasyon, gömme ve kesit alma işlemlerini içerebilir ancak genellikle bir veya iki deneysel değişken kesin iş akışını belirler.
IHC numune hazırlamadaki ek adımlar, fiksasyonla değişen epitopları ortaya çıkarmak için antijen geri kazanımı, antikorun hücre içi proteinlere erişimini sağlamak için permeabilizasyon ve spesifik olmayan boyamayı önlemek için bloklamayı içerebilir.
IHC’de doku fiksasyonu
Doku numunesinin fiksasyonu, IHC deneyi ve depolama süresince doku morfolojisini korumak ve de hedef proteinin antijenitesini muhafaza etmek için gereklidir. Fiksasyon ayrıca doku bileşenlerinin kırılma indeksini artırabilir ve böylece kesit alma sırasında dokuya destek sağlayabilir.
Fiksatif seçimi, hedef antijene ve istenen saptama tekniğine (floresan veya kromojenik boyama) bağlıdır. Ayrıca, fiksasyon yöntemi, numune hazırlama sürecinin geri kalan adımları için bir “yol haritası” görevi görür; örneğin, fosforile bir epitop inceleniyorsa dokuların ani dondurulması gerekebilir. Fiksasyon genellikle parafine gömmeden önce, dondurulmuş dokular için ise dondurulduktan sonra gerçekleştirilir.
IHC’de parafine gömülü numunelerin kullanımı
Parafine gömülü doku numuneleri oluşturulurken, doku parafine gömülmeden önce fikse edilmelidir. Fiksasyon, diseksiyon işleminden hemen sonra perfüzyon veya immersiyon ile gerçekleştirilir ve genellikle 4-24 saat sürer. 24 saatten uzun süren fiksasyon, antijeni maskeleyebileceği için aşırı fiksasyona yol açabileceğinden immünhistokimyasal boyama yapılacak dokular için 24 saatten daha uzun süreli fiksasyon önerilmez.
Uygun şekilde fikse edilmemiş bir antijenin saptanamaması nedeniyle her antijen türü için standartlaştırılmış fiksatifler, tekrarlanabilir boyama için gereklidir. Bir IHC deneyi için en uygun fiksatif, aşağıdaki şekilde gösterildiği gibi antijene bağlıdır. Kullanılacak fiksatif türü için bazı yönergeler Tablo 1’de verilmiştir.
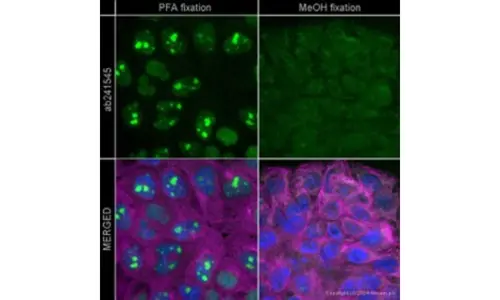
Şekil 1. Fiksatifin İmmünboyama Boyama Üzerindeki Etkisi- Hedef protein Werner sendromu helikaz WRN, PFA (sol) ile fikse edilmiş A431 hücrelerinin immünositokimyasında saptanır ve beklenen nükleer lokalizasyonu gösterir. Ancak, MeOH fiksasyonlu hücrelerde lokalizasyon çekirdekte ve sitoplazmada zayıftır ve bu da spesifik olmayan bağlanmayı gösterir. Primer: ab241545, Werner sendromu helikaz WRN’ye karşı fare monoklonal [195C], 5 μg/ml. Sekonder: ab150117, keçi anti-fare IgG H&L (Alexa Fluor® 488), 2 μg/mL (yeşil olarak gösterilmiştir). Çekirdekler DAPI ile (mavi olarak gösterilmiştir) ve tübülin ab6046 ve ab150080 ile (magenta olarak gösterilmiştir) boyanmıştır.
Fiksasyondan sonra, doku, suda çözünmeyen parafine gömülmeyi sağlamak için dehidre edilir. Doku, alkol gibi bir dehidrasyon maddesinin artan konsantrasyonlarına batırılarak yavaşça dehidre edilir. Hidrofobiklikteki bu kademeli değişim, hücre hasarını en aza indirir.
Parafine gömmeden önce ksilende inkübasyon yoluyla dehidrasyon maddesi temizlenir. Parafin genellikle 60°C’ye ısıtılır ve ardından bir gece boyunca katılaşmaya bırakılır. Son olarak, bir mikrotom kullanarak dokudan çok ince kesitler alınır. Kesitlerin polilizin kaplı ya da pozitif şartjlı lamlar üzerine alınması önerilir; bu boyama prosedürü süresince lamlardaki doku kesitlerinin düşmesini engelleyecektir.
Doku kesitleri mikroskop lamları üzerinde kurutulabilir ve oda sıcaklığında uzun süre saklanabilir. İmmünboyama protokolüne başlamadan önce doku kesitlerini rehidre edin.
IHC’de donmuş numunelerin kullanımı
Donmuş numuneleri, dokuyu sıvı nitrojen, izopentana batırarak veya kuru buzun içine gömerek hazırlayın. Ani dondurma, genellikle fosforilasyon gibi translasyon sonrası modifikasyonları saptarken kullanılır.
Dondurulduktan sonra, dokuyu bir kriyostat kullanarak kesin. Ortaya çıkan kesitler bir yıla kadar -80°C’de saklanabilir. Dondurulmuş doku kesitleri lam üzerine alındıktan sonra genellikle metanol veya etanol gibi bir alkolle fikse edilir. Alkoller epitopları maskelemediğinden, bunların kullanımı antijen geri kazanımı ihtiyacını ortadan kaldırır.
Formaldehit ve formalin arasındaki fark nedir?
Formaldehit, sulu bir çözeltide kimyasal özelliklerini koruyan bir gazdır, formalin ise suda %37-40 (ağırlık/hacim) oranında doymuş bir formaldehit çözeltisidir. Bu nedenle, %10 formalin yaklaşık olarak %4 formaldehite eşdeğerdir.
Formalin, üreticinin çözeltideki formaldehitin paraformaldehite polimerleşmesini yavaşlatmak için eklediği yaklaşık %10 metanol içerir. Bu nedenle, paraformaldehit, büyük formaldehit polimerlerinden oluşan katı bir maddedir.
Eklenen metanol bazı numunelerin fiksasyonunu olumsuz etkileyebileceğinden, bazı protokoller, numune fiksasyonundan hemen önce paraformaldehitten formalin hazırlamayı önerir.
Tablo 1. Bir fiksatif seçerken kullanılabilecek yönergeler
Antijen | Tavsiye edilen fiksatif |
Düşük moleküler ağırlıktaki çoğu protein, peptit ve enzimler | Hücreler/sitolojik hazırlıklar: %4 formaldehit; Doku kesitleri: %10 Nötr Tamponlu Formalin (NTF) |
Hassas doku | Bouin fiksatifi |
Amino asitler gibi küçük moleküller | %4 formaldehit |
Kan oluşturan organlar (karaciğer, dalak, kemik iliği) | Zenker çözeltisi |
Bağ dokusu | Helly çözeltisi |
Nükleik asitler | Carnoy çözeltisi |
Büyük protein antijenleri (örn. immünoglobulin) | Soğuk aseton veya metanol (%100) |
Çekirdek morfolojisi | Çinko formalin |
Elektron mikroskobu için | %4 formaldehit- %1 glutaraldehit |
Alexa Fluor®, bir Thermo Fisher Scientific Şirketi olan Molecular Probes, Inc.’in tescilli ticari markasıdır. Alexa Fluor® boya konjugatları, Life Technologies tarafından Abcam’e lisanslanmış teknolojiyi içerir.
Antijen geri kazanımı ve IHC için permeabilizasyon
Numune hazırlamadan sonra, şu iki adım gerekli olabilir: antijen geri kazanımı ve permeabilizasyon.
Antijen geri kazanımı
Numune fiksasyon işlemi bazen protein çapraz bağlanmasına yol açabilir; bu da antijenleri maskeler ve antijen-antikor bağlanmasını kısıtlayabilir. Antijen geri kazanımı, bir antikorun doku içindeki hedef proteine erişmesini sağlar. Fiksasyon zayıfsa bu adım gerekli değildir. Örneğin, dondurulmuş dokular alkolle fikse edilmişse, alkoller epitopları maskelemediğinden antijen geri kazanımı gerekmez.
Maskelenmiş epitoplar, enzimatik/proteolitik antijen geri kazanımı (PIER) veya ısıyla indüklenmiş antijen geri kazanımı (HIER) yöntemleri kullanılarak geri kazanılabilir. PIER proteinaz K, tripsin ve pepsin gibi proteazlar kullanırken, HIER ısı (mikrodalga, düdüklü tencere, buharlı pişirici, su banyosu veya otoklav) ve bir dizi tampon kullanır. HIER ve PIER’in karşılaştırması için aşağıdaki Tablo 2’ye bakın.
En uygun antijen geri kazanım tekniği, antijen, doku, fiksasyon yöntemi ve primer antikor dahil olmak üzere çeşitli faktörlere bağlıdır. Bazı antijenler, ısıtma ve enzim sindiriminin bir kombinasyonunu gerektirir. Spesifik antijeniniz için en iyi yöntemi belirlemek adına, sitrat tamponu pH 6 ve Tris-EDTA pH 9 gibi iki HIER yöntemini ve proteinaz K ve tripsin gibi bir veya iki PIER yöntemini test etmenizi öneririz.
Tablo 2. HIER ve PIER antjen geri kazanımı yöntemlerinin karşılaştırılması
| HIER | PIER |
Avantajlar | Daha hassas epitop geri kazanımı ve daha tanımlanabilir parametreler | Geri kazanılması zor olan epitoplar için kullanışlıdır. |
pH | pH 6 sitrat tamponları sıklıkla kullanılır, ancak yüksek pH tamponlarının birçok antikor için yaygın olarak uygulanabilir olduğu gösterilmiştir. En uygun pH deneysel olarak belirlenmelidir. | Genellikle, pH 7.4. |
Sıcaklık | Yaklaşık olarak 95˚C | Genellikle, 37˚C |
İnkübasyon Süresi | 10-20 dakika (genellikle, 20 dakika) | 5-30 dakika (genellikle, 10-15 dakika) |
Tampon bileşimi | Gerekli pH’a bağlıdır (pH hedefe bağlıdır). En yaygın kullanılan tamponlar arasında sodyum sitrat, EDTA ve Tris-EDTA bulunur. | Pepsin, proteinaz K veya tripsin gibi enzimlerin nötr tampon çözeltileri |
Önlemler | Bir mikrodalga kullanılarak ısıtma, eşit olmayan ısıtma nedeniyle dengesiz epitop geri kazanımına neden olabilir. Kaynatma ayrıca dokunun lamdan kalkmasına neden olabilir. | Aşırı enzimatik geri kazanım bazen doku morfolojisine zarar verir. |
IHC için permeabilizasyon
Antikorun hedef antijeni saptamak adına hücrelerin içine erişebilmesi için permeabilizasyon gereklidir. Bu tür antijenler arasında hücre içi proteinler ve transmembran proteinlerinin sitoplazmik epitopları bulunur.
Permeabilizasyon için genellikle çözücüler veya deterjanlar kullanılır. Çözücüler genellikle hücre iskeleti, viral ve bazı enzim antijenleri için önerilir. Deterjan permeabilizasyonu, sitoplazmadaki, plazma membranının sitoplazmik yüzeyindeki antijenlere ve çözünebilir nükleer antijenlere antikor erişimini önemli ölçüde sağlayabilir. İlgili antijeninize bağlı olarak, sert veya hafif deterjanlar kullanılabilir. Triton™ X-100 veya NP-40 gibi sert deterjanlar proteinleri bozabilirken, Tween 20®, saponin veya digitonin gibi hafif deterjanlar plazma zarlarını çözmez.
Tablo 3. Çözücü ve deterjan yönergeleri
| Çözücüler | Açıklamalar |
Çözücüler | Aseton | Aseton fiksasyonu da permeabilize olacaktır. |
Metanol | Metanol fiksasyonu permeabilize etmek için kullanılabilir ancak genellikle etkili değildir. | |
Deterjanlar | Triton™ X-100 veya NP-40 | Sadece 10 dakika boyunca PBS’de %0. İla %0.2 oranında kullanın. |
Tween 20®, saponin, digitonin ve Leucoperm | %0,2 ila %0,5 oranında 10 ila 30 dakika kullanın. |
Bloklama
Bloklama, arka plan sinyallerini (zemin boyanmayı) ve yanlış pozitifleri azalttığı için immünohistokimya (IHC) deneylerinizde gerekli bir adımdır.
Numune hazırlığından sonra, ancak genellikle primer antikorla inkübasyondan önce bloklama gerçekleştirilir. IHC, belirli antijenleri tanımak için antikorlar kullandığından, spesifik olmayan bağlanmayı önlemek için bloklama çok önemlidir. Bu adım olmazsa, primer antikor birkaç bölgeye bağlanabilir ve yanlış pozitif bir sonuca neden olabilir.
IHC’de protein bloklama
Serum, spesifik olmayan bölgelere bağlanan antikorlar içerdiğinden yaygın bir protein bloklama maddesidir. En iyi sonuçlar için, sekonder antikor türleriyle eşleşen bir serum kullanın; bu, spesifik olmayan bağlanma bölgelerinin saptanmasını önler (Şekil 2). Farklı türlerden sekonder antikorlar kullanarak çoklu boyama yapıyorsanız, her iki sekonder antikorun türünden bloklama serumları kullanmanız gerekebilir.
Sık kullanılan diğer protein bloklama reaktifleri, sığır serum albümini (BSA) ve yağsız süt tozundan alınan kazeindir. Genellikle performansı veya raf ömrünü optimize etmek için formüle edilmiş önceden formüle edilen bloklama tamponları da mevcuttur. Bu yöntemlerin sekonder antikorun türüyle eşleştirilmesi gerekmez.
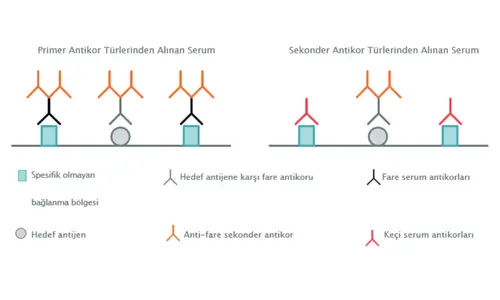
Şekil 2. Primer ve sekonder antikorlarla spesifik ve spesifik olmayan bağlanma bölgelerinin saptanması.
Fare dokuları üzerinde fare antikorlarının kullanımı
Fare dokusuyla fare primer antikorları kullanırken ekstra özen gösterilmelidir. Anti-fare sekonder antikoru, endojen fare IgG’sine ve Fc reseptörlerine bağlandığı için yüksek arka plan boyaması meydana gelebilir. Bu arka plan bağlanması, fare-üzerinde-fare (mouse on mouse) protokolümüzde açıklandığı gibi F(ab) parçacıkları kullanılarak azaltılabilir ve bloklama parçası ve kullanılan sekonder antikorun dikkatlice eşleştirilmesi önemlidir.
IHC’de otofloresanı azaltma
Saptama için bir floresan etiketi kullanılıyorsa, dokunuzda otofloresan olup olmadığını kontrol edin, çünkü bu yanlış pozitif sonuçlara ve yüksek arka plana (zemin boyanmaya) yol açabilir. Fiksasyon yöntemi ve floresan bileşikleri dahil olmak üzere otofloresanın çeşitli nedenleri vardır. Bununla birlikte, endojen otofloresansı bloke edilemiyorsa, kromojenik bir saptama sistemi tercih edilebilir.
Otofloresanı azaltmak için nedenler ve ipuçları:
-Özellikle floresan ürünleri oluşturmak için aminlerle reaksiyona giren aldehit fiksatifleri (örn. formalin) kullanıldığında doku fiksasyonu. Bu şu yollarla azaltılabilir:
- Carnoy çözeltisi gibi aldehit olmayan fiksatifler kullanın.
- Numuneleri sodyum borohidrit veya glisin/lizin ile işleme sokarak aldehitleri bloke edin.
- Donmuş doku kesitleri kullanın.
- Dokuyu pontamin gökyüzü mavisi, Sudan siyahı, tripan mavisi veya FITC bloğu gibi söndürme boyalarıyla işleme sokun.
-Flavinler ve porfirinler gibi floresan bileşikleri. Bunların etkisi şu yollarla azaltılabilir:
Bu bileşikleri, fikse edilmiş, dehidre kesitler oluşturmak için kullanılan çözücülerle dokudan çıkarın. Bununla birlikte, sulu reaktifler kullanılarak işlemden geçmiş olan dondurulmuş kesitlerde kalırlar.
Endojen enzimlerin bloklanması
Kromojenik saptama, hedef antijeni görselleştirmek için enzimleri kullanır. Bu nedenle, saptamadan önce endojen enzimlerin bloklanması gerekir.
Biyotin bloklama
Biyotin bazlı bir saptama sistemi kullanıyorsanız, endojen biyotini bloklamanız önerilir. İlk olarak, doğal olarak oluşan herhangi bir biyotine bağlanmak için numuneye aşırı miktarda avidin eklenir. Bunu, avidin molekülü üzerindeki ek bağlanma bölgelerini bloklamak için aşırı miktarda biyotin ile inkübasyon izler.
Böbrek, karaciğer ve beyin gibi numunede yüksek miktarda endojen biyotin varsa, polimer bazlı bir yöntem kullanmayı düşünün. Polimer yöntemleri, biyotin içermez; çoklu enzim moleküllerinin ve sekonder antikorların bağlandığı bir dekstran omurgası kullanır.
Peroksidaz bloklama
Böbrek, karaciğer ve kırmızı kan hücreleri içerenler (vasküler doku gibi) dahil olmak üzere bazı dokular, endojen peroksidazlar içerir. İlgili proteinleri görüntülemek için horseradish peroksidaz (HRP) kullanıyorsanız, numuneyi 3,3′-diaminobenzidin (DAB) substratında inkübe ederek endojen peroksidaz aktivitesini kontrol edin. Numune kahverengiye dönerse, endojen peroksidaz mevcuttur ve bir bloklama adımı gereklidir. %0,3 hidrojen peroksitte 10-15 dakikalık bir inkübasyon genellikle yeterli bloklamadır.
Alkalin fosfataz bloklama
Endojen alkalin fosfataz (AP), böbrek, bağırsak, osteoblastlar, lenfoid doku ve plasentada bulunabilir ve genellikle donmuş dokuda daha yüksek etkinliğe sahiptir.
Saptama için AP kullanıyorsanız, numuneyi bir BCIP/NBT çözeltisi ile inkübe ederek endojen AP içerip içermediğini belirleyin. Numune maviye dönerse, endojen AP mevcuttur ve bloklama gereklidir. Bloklama, levamizol hidroklorür veya tetramizol hidroklorür gibi bir alkalin fosfataz inhibitörü ile inkübasyon yoluyla sağlanır.
IHC’de antikorlar
Doğru antikorları seçmek, IHC deneyinin başarılı olması için oldukça önemlidir.
Doğrudan ve dolaylı saptama
Başarılı immünboyama, primer antikorun hedef antijene spesifik olarak bağlanmasına dayanır. Antikor daha sonra ya doğrudan primer antikora konjuge edilmiş bir etiket aracılığıyla ya da dolaylı olarak, etiketli bir sekonder antikor kullanılarak saptanır.
Doğrudan saptama, yüksek oranda eksprese edilen antijenleri saptamak için idealdir ve sekonder bir reaktif ile ek bir inkübasyon adımı gerektirmez. Dolaylı saptama, sekonder reaktif tarafından sağlanan sinyal amplifikasyonu sebebiyle, düşük oranda eksprese edilen antijenlerin incelenmeleri için daha uygundur.
Sinyal amplifikasyonu, iki veya daha fazla etiketli sekonder antikorun her bir primer antikora bağlanma potansiyeli aracılığıyla gerçekleşir. Biyotinlenmiş sekonder antikorlarla avidin veya streptavidin kullanılarak sinyal daha da güçlendirilebilir. Ancak, sekonder bir antikorun kullanımı ek bloklama adımları ve kontrolleri gerektirir.
| Doğrudan | Dolaylı |
Avantajlar | Çok renkli deneyler için artan esneklik | Tüm antijenler için uygundur. |
Ek inkübasyon adımına gerek yoktur. | Sinyal daha da arttırılabilir. | |
| Sekonder bir antikordan kaynaklanabilecek potansiyel arka plan boyamasını ortadan kaldırır. |
|
Dezavantajlar | Sadece yüksek oranda eksprese edilen antijenler için uygundur. | Ek bloklama adımları ve kontrolleri gerektirir. |
IHC için primer antikor seçmek ve optimize etmek
IHC deneyinin başarılı olması için primer antikor seçimi oldukça önemli olduğundan, bu faktörleri göz önünde bulundurmak gereklidir.
Antikor ilgili protein/epitop’a özgü mü?
Antikorun özgüllüğü genellikle deneysel olarak belirlenir. Kontrol hücrelerinde veya dokularındaki hedef proteinin bilinen lokalizasyonuyla tutarlı boyama desenleri özgüllüğü gösterebilir.
İmmünojen sekansının BLAST gibi hizalama araçları kullanılarak diğer proteinlerle karşılaştırılması da antikor özgüllüğünü gösterebilir, ancak bu kesin değildir.
Antikor özgüllüğünün en kesin göstergesi, hedef proteinin yok edildiği (nakavt) doku veya hücrelerde boyamanın olmamasıdır.
Antikorun IHC’de çalıştığı kanıtlandı mı?
Antikorlar, antijen tanımadaki farklılıklar nedeniyle farklı teknikler için doğrulanır. Örneğin, Western Blot deneyleri denatüre edici koşullar altında yürütülürken, proteinin doğal (3D) formunun IHC’de korunma olasılığı daha yüksektir. Sonuç olarak, Western Blot için doğrulanmış bir antikor IHC’de çalışmayabilir.
Fiksasyon ve antijen geri kazanım yöntemlerinin de bir antikorun bir IHC deneyindeki ilgili epitopu tanıma yeteneğini önemli ölçüde etkilediğini unutmamak önemlidir.
Antikor üretimi yöntemi
Üç ana antikor üretim yöntemi vardır – serumdan saflaştırılmış poliklonal, hibridomadan türetilmiş monoklonal ve rekombinant. Antikor üretim türü sonuçlarınızı önemli ölçüde etkileyebilir, bu nedenle farklı yöntemleri anlamak önemlidir:
— Serumdan saflaştırılmış poliklonal antikorlar, bir hayvanın ilgili antijenle immünize edilmesiyle elde edilen heterojen bir antikor karışımıdır.
— Hibridomadan türetilmiş monoklonal antikorlar, bir miyeloma ile kaynaştırılmış tek bir klon antikor üreten B hücresinden üretilir.
— Rekombinant olarak üretilmiş antikorlar, antikor kodlayan genlerin yüksek verimli ekspresyon vektörlerine klonlanmasıyla rekombinant olarak üretilir.
Primer antikor için hangi konak türleri kullanılmalı?
Tercihen, dokudaki endojen immünoglobulinlerle çapraz reaksiyonu önlemek için primer antikor, numune türünden farklı bir konak türünde üretilmelidir. Fare dokusunda bir fare primer antikoru kullanıyorsanız, özel fare-üzerine-fare (mouse on mouse) IHC kitlerini kullanmanız gerekir.
Antikor optimizasyonu
Boyamanın kalitesi, primer antikor konsantrasyonu, kullanılan seyreltici, inkübasyon süresi ve sıcaklığı dahil olmak üzere birçok değişkenden etkilenir. Minimum arka plan ile spesifik boyama elde etmek için her antikor ve numune için optimizasyon gerekebilir. En iyi boyamayı elde etmek için:
— Sabit bir inkübasyon süresini ve sıcaklığı koruyarak antikor konsantrasyonunu değiştirin.
— Antikorun dokuya nüfuz etmesine yardımcı olmak için daha uzun bir inkübasyon süresi deneyin.
— Spesifik bağlanmayı desteklemek için daha uzun inkübasyon sürelerini daha düşük sıcaklıklarla bir araya getirin, örneğin oda sıcaklığında 1 saat yerine 4°C’de gece boyunca deneyin.
IHC’de sekonder antikorlar
Spesifik olmayan bağlanmayı iyileştirmek için, sekonder antikorun, primer antikorun üretildiği türü hedef alması, ancak kendisinin farklı bir türde üretilmiş olması gerekir.
Örneğin, primer antikor tavşanda üretilmişse, tavşan dışında bir türde üretilmiş bir anti-tavşan sekonder antikoru kullanılmalıdır. Sekonder antikorun üretildiği izotipin, primer antikorun izotipiyle eşleşmesi de önemlidir.
Primer antikorlarda olduğu gibi, en uygun sekonder antikor için de dikkate alınması gereken noktalar vardır.
Sekonder antikorun ön adsorpsiyonu
Ön-adsorpsiyon, bir sekonder antikorun özgüllüğünü artırmak için ek bir saflaştırma adımıdır. Sekonder antikor, yüksek özgüllüklü antikorları spesifik olmayan antikorlardan ayırmak için immobilize serum proteinleri içeren bir sütun matrisinden geçirilir.
F(ab’)2 parçacığı sekonder antikorlar
F(ab’)2 parçacığı sekonder antikorları, Fc reseptörleri açısından zengin dokuların (örneğin dalak, timüs, kan) boyanması için önerilir. Daha küçük olan ve dokulara daha etkili bir şekilde nüfuz eden F(ab’)2 parçacığı sekonder antikorları, çoklu IHC boyaması için faydalıdır.
Düşük eksprese olan proteinler için HRP-polimer sekonder antikorlar
Daha yüksek hassasiyet için, horseradish peroksidaz (HRP)-polimer sekonder antikorları, gelişmiş doku penetrasyonu ve hassasiyeti sağlayan daha küçük saptama kompleksleri oluşturmak için mikro polimer teknolojisini kullanır. Ek olarak, HRP-polimer sekonderleri, standart HRP sekonder antikorlarından daha fazla HRP bağlayarak sinyali artırır.
Tespit ve amplifikasyon sistemleri
IHC’de antijenler ya kromojenik ya da floresan yöntemlerle saptanabilir.
Kromojenik tespit, çözünebilir substratları çözünemeyen kromojenik ürünlere dönüştüren enzimlere dayanır. Alternatif olarak, floresan saptama, belirli bir dalga boyundaki ışıkla uyarıldığında daha uzun bir dalga boyunda ışık yayan florokrom etiketleri kullanır.
IHC’de kromojenik tespit
Kromojenik saptamada antijenleri saptamak için kullanılan enzimler genellikle sekonder antikorlara konjuge edilir, ancak doğrudan enzime konjuge edilmiş primer antikorlar da kullanılabilir.
En yaygın kullanılan kromojenler, horseradish peroksidazı (HRP’yi) kahverengi bir ürüne dönüştüren 3,3′-diaminobenzidin (DAB) dır; ve yine HRP’yi kırmızı bir ürüne dönüştüren 3-amino-9-etil karbazolü (AEC) dir.
Ancak, kromojen seçiminin kullanılan enzime göre belirlenmesi gerektiği unutulmamalıdır.
Tablo 4. Hangi kromojeni kullanacağınızı seçmek için yönergeleri inceleyin.
Enzim | Kromojen | Renk | Gömme ortamı | Avantajlar (+) ve dezavantajlar (-) |
Horseradish peroksidaz (HRP) | AEC | Kırmızı | Sulu | + Yoğun renk, çift boyamada mavi ile iyi kontrast oluşturur. |
Horseradish peroksidaz (HRP) | DAB | Kahverengi | Organik | + Yoğun renk, kalıcı. |
Horseradish peroksidaz (HRP) | DAB + nikel geliştirici | Siyah | Organik | + Yoğun renk, kalıcı. |
Horseradish peroksidaz (HRP) | TMB | Mavi | Sulu | + Yoğun renk, kalıcı. |
Horseradish peroksidaz (HRP) | StayYellow | Sarı | Sulu | + Çok renkli kromojenik IHC’de kullanışlı alternatif renk. |
Alkalin fosfataz (AP) | BCIP/NBT | Mavi | Organik | + Yoğun renk. |
Alkalin fosfataz (AP) | BCIP/TNBT | Mor | Organik | + Yoğun renk. |
Alkalin fosfataz (AP) | Naphthol AS-MX phosphate + Fast Blue BB | Mavi | Sulu | + Daha az yoğun, çift boyama için iyi. – Fast Blue BB solmaya eğilimli. |
Alkalin fosfataz (AP) | Naphthol AS-MX phosphate + Fast Red TR | Kırmızı | Sulu | + Daha az yoğun, çift boyama için iyi. – Fast Red TR solmaya eğilimli. |
Alkalin fosfataz (AP) | Naphthol AS-MX phosphate + new fuchsin | Kırmızı | Organik | + Yoğun renk. – Fast Red TR solmaya eğilimli. |
Alkalin fosfataz (AP) | StayGreen | Yeşil | Organik | + Çok renkli kromojenik IHC’de kullanışlı alternatif renk. |
Glukoz oksidaz | NBT | Mavi | Organik | + Endojen enzim aktivitesi yoktur, bu nedenle yanlış pozitif boyamaya neden olan endojen peroksidazlardan etkilenmez. -Düşük boyama yoğunluğu. Yüksek antikor konsantrasyonları gerekli. |
Dolaylı kromojenik saptamanın dört temel yöntemi yaygın olarak kullanılmaktadır. Biyotin bazlı yöntemler, bir avidin-biyotin kompleksi (ABC) veya etiketli bir streptavidin-biyotin bağlama (LSAB) kompleksi kullanır. Biyotin bazlı olmayan yöntemler ise bir polimer kompleksi veya bir mikropolimer kompleksi kullanır.
Avidin-biyotin kompleksi (ABC) yöntemi
ABC yönteminin ilk kullanımları, biyotinlenmiş sekonder antikorlara ve bir avidin-biyotin-raportör enzim kompleksine dayanıyordu. Avidin tetravalan (dört bağlanma bölgesine sahip) olduğundan, büyük kompleksler oluşur ve bu da yüksek sinyal yoğunluğuna yol açar.
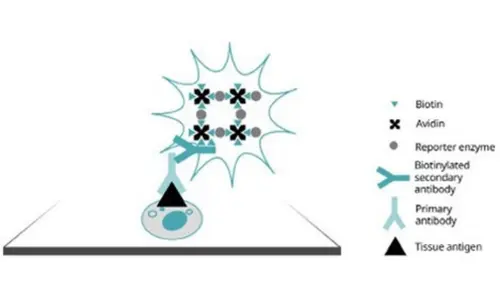
Şekil 3. Avidin-biyotin kompleksi yöntemi aracılığıyla antikor deteksiyonu.
Etiketli strptavidin biyotin (LSAB) yöntemi
Şu anda çoğu saptama, avidin yerine streptavidin kullanan ABC yönteminin LSAB varyantına dayanmaktadır. Streptavidin glikozillenmediği ve avidinden daha nötr bir izoelektrik noktasına sahip olduğu için bu, daha az, spesifik olmayan doku bağlanmasına neden olur.
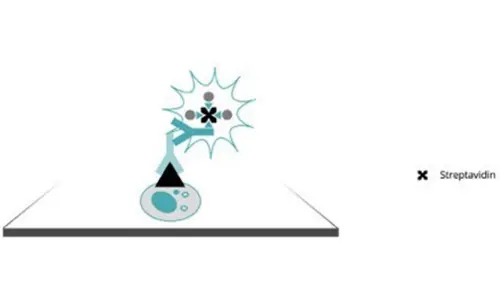
Şekil 4. Streptavidin-biyotin yöntemi aracılığıyla antikor tespiti.
Polimer yöntemleri
Biyotin bazlı sistemlerin temel zorluğu, endojen biyotinin belirli dokularda (örneğin beyin) önemli arka plan boyanmasına yol açabilmesidir. Formalin fiksasyonu ve parafine gömme biyotin seviyelerini düşürse de antijen geri kazanımı biyotini açığa çıkarabilir.
Dondurulmuş kesitlerde, endojen biyotin önemli bir sorundur. Arka planı azaltmak için biyotin bloklama çözeltileriyle ek adımlar kullanılabilse de biyotin içermeyen polimer bazlı yöntemler bir alternatif sunar.
İlk polimer yöntemleri, çoklu enzim molekülünün ve sekonder antikorların bağlandığı bir dekstran omurgası kullanmıştır. Daha yeni olan mikro-polimer / kompakt polimer yöntemleri, kümelenmeye daha az eğilimli daha küçük bir saptama kompleksi kullanır. Bu, daha iyi doku penetrasyonu ve endojen biyotinden kaynaklanan azaltılmış arka plan boyaması yoluyla daha yüksek hassasiyet sağlar.
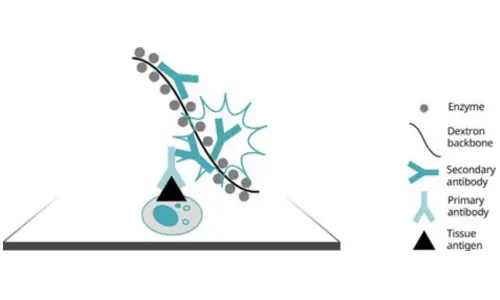
Şekil 5. Dekstran omurgası aracılığıyla antikor tespiti.
IHC için karşıt boyalar ve özel boyalar
Primer antikor boyamasının yerini belirlemeye yardımcı olmak için histoloji, floresan ve özel boyalar, belirli hücre ve doku yapılarını ve mikroorganizmaları boyamak için kullanılır.
Primer antikor HRP veya alkalin fosfataz ile birlikte DAB, AEC veya benzer enzim substratları kullanılarak görüntülendiğinde, doku morfolojisini daha iy ayırdedebilmek için kormojen inkübasyon adımından sonra kromojenik karşıt boyalar kullanılır. Geleneksel kombinasyon, DAB veya AEC kromojen inkübasyonu ardından, çekirdekleri boyamak için Mayer’s hematoksilen kullanılmasıdır. Sitoplazmik boyama için eozin genellikle hematoksilen ile kullanılır.
Primer antikor boyaması, primer veya sekonder antikora doğrudan konjuge edilmiş bir floresan boya ile görüntülendiğinde floresan karşıt boyalar kullanılır. Primer antikor görüntülemesi için kullanılan boyayla örtüşen bir emisyon spektrumuna sahip bir karşıt boya kullanmaktan kaçınmalısınız. DAPI geleneksel olarak en yaygın floresan nükleer karşıt boyadır.
Özel boyalar, hücre türlerini, mikroorganizmaları, belirli proteinleri, karbonhidratları ve doku matrisinde ve hücreler içinde bulunan metabolitleri boyamak için kullanılır.
Kurulduktan sonra kullanımı basit olsa da özel boyaların kurulumu ve optimizasyonu genellikle zaman alıcıdır. Optimize edilmiş özel boya kitleri, kendi boyanızı ayarlamanız için uygun bir alternatif sunar ve genellikle geleneksel boyama yöntemlerinden daha hızlı kullanılırlar.
Tablo 5. Yaygın karşıt boyalar ve hedefleri
Tür | Boya | Hedef | Renk |
Kromojenik | Hematoksilin | Çekirdek | Maviden mora |
Kromojenik | Nuclear fast red (Kernechtrot) | Nükleik asitler | Kırmızı |
Kromojenik | Metil yeşili | Nükleik asitler | Yeşil |
Floresan | DRAQ5™ | Nükleik asitler | Kırmızı |
Floresan | DRAQ7™ | Nükleik asitler | Kırmızı |
Floresan | Nuclear yellow (Hoechst S769121) | Nükleik asitler | Sarı/Mavi |
Floresan | Nuclear Green DCS1 | Nükleik asitler | Yeşil |
Floresan | Hoechst boyası | Nükleik asitler | Mavi |
Floresan | DAPI | Nükleik asitler | Mavi |
Floresan | Propidyum iyodür | Nükleik asitler | Kırmızı |
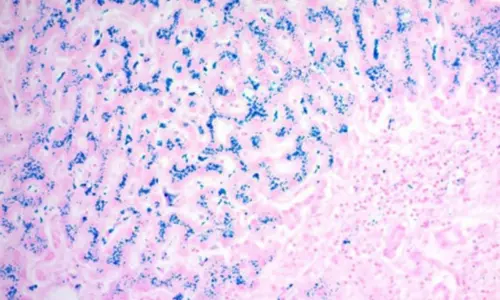
Şekil 6. Özel boyalar ve karşıt boyaların kullanımına örnek. Karaciğer dokusundaki demiri (mavi) boyayan Prusya mavisi demir boyama kiti. Çekirdekler ve arka plan, nuclear fast red ile karşıt boyanmıştır.
Kromojenik saptamanın floresan saptamasına göre avantajları
Kromojenik saptama, daha yüksek sinyal amplifikasyonu nedeniyle genellikle floresan saptamadan daha hassastır. Ayrıca, floroforların aksine, DAB gibi substratlardan oluşturulan renkli çökelmeler ışığa dayanıklıdır ve lamların uzun yıllar saklanmasını sağlar.
Floresan saptama özel ışık kaynakları ve filtreler gerektirirken, kromojenik saptama yalnızca standart bir ışık mikroskobu gerektirir. Bununla birlikte, floresan yöntemlerine göre daha fazla inkübasyon ve bloklama adımı içerdiği için deneysel prosedür daha uzundur.
IHC’de çok renkli ve floresan saptama
Kromojenler kullanılarak aynı anda üç antijene kadar boyama mümkündür ve bu genellikle farklı türlerde üretilmiş primer antikorlar gerektirir. Antijen yeterince yüksek bir seviyede mevcutsa, doğrudan raportör enzime konjuge edilmiş bir primer antikor kullanılabilir. Aynı türde üretilmiş iki primer antikor kullanıyorsanız, ikinci primer antikorla boyamadan önce sekonder antikordaki bağlanma bölgeleri bloklanmalıdır.
Alternatif olarak, floresan saptama, birden fazla antijeni aynı anda görselleştirmek için yaygın olarak kullanılır. Florokrom doğrudan primer veya sekonder antikora veya streptavidine konjuge edilebilir.
Çok renkli deneyler tasarlarken, iki temel parametre göz önünde bulundurulmalıdır:
- Kullanılan florokromlar arasındaki spektral örtüşme mümkün olduğunca sınırlandırılmalıdır.
- Dolaylı saptama yöntemleri kullanılıyorsa, saptama reaktifleri arasındaki çapraz reaksiyondan mümkün olduğunca kaçınılmalıdır. Bu genellikle farklı türlerden primer antikorlar seçilerek ve her sekonder antikorun deneyde yalnızca bir primer antikoru tanımasını sağlayarak elde edilir.
Primer antikorlardan biri biyotinlenmişse, aynı türden iki primer antikor kullanılabilir. Doku önce biyotinlenmemiş antikor ve karşılık gelen florokrom konjuge sekonder antikor ile inkübe edilir. Doku daha sonra biyotinlenmiş antikor ve ardından streptavidin konjuge bir florofor ile inkübe edilir. Bu yöntem, özellikle donmuş dokular kullanılırken, endojen biyotin nedeniyle oluşan yüksek arka plan boyamasına karşı hassastır.
Gömme ortamı (Kapatma maddesi)
Boyamadan sonra, bir lameli bir doku kesitine veya hücre simirine (smear) yapıştırmak için bir gömme ortamı kullanılır. Doku örneğini gömme, depolama süresince korunması ve mikroskopi sırasında görüntüleme kalitesinin artırılması için gereklidir.
Kapatma maddesinin iki kategorisi vardır: organik bazlı ve su bazlı (veya sırasıyla hidrofobik ve hidrofilik). Organik gömme ortamları yalnızca, enzim ve kromojen arasında oluşan çökeltinin, dokunun gömülmesi sırasında kullanılan organik çözücülerde çözünmediği enzimatik etiketler için kullanılabilir (örneğin diaminobenzidin, DAB).
Sulu gömme ortamları genellikle tüm enzimatik etiket/kromojen kombinasyonları ve floresan etiketler için uygundur. Floresan etiketler kullanıyorsanız, uzun süreli depolamadan sonra numunelerin görüntülenmesini sağlamak için floresanı koruyan (floresanın solma süresini uzatan) bir gömme ortamı kullanın.
Floresan olmayan görüntüleme için tavsiye edilen gömme ortamı
Ürün adı | Tür |
Limonene Mounting Medium | Organik |
Mounting Medium for IHC | Sulu |
Floresan görüntüleme için tavsiye edilen gömme ortamı
Ürün adı | Tür |
Anti-Fade Mounting Medium | Sulu |
Anti-Fade Mounting Medium With DAPI | Sulu |
Anti-Fade Mounting Medium With PI | Sulu |
IHC’de kontroller
Gözlemlenen boyama deseninin doğru ve güvenilir olduğunu doğrulamak için IHC boyama deneylerinde kontroller ile çalışmak önemlidir.
Antijen (doku) kontrolleri
Pozitif kontrol
Pozitif kontrolün, ilgili proteini eksprese ettiği bilinmektedir. Numuneler negatif olsa bile, pozitif kontrolden elde edilen pozitif sonuçlar, prosedürün çalıştığını ve optimize edildiğini göstererek, herhangi bir negatif sonucun geçerli olduğunu doğrular.
Negatif kontrol
Bir negatif kontrolün, hedef antijeni eksprese etmediği bilinmektedir. Bu, spesifik olmayan sinyalleri ve yanlış pozitif sonuçları kontrol etmek içindir.
Endojen doku arka plan kontrolü
Bir endojen doku arka plan kontrolü, primer antikor uygulanmadan önceki dokudan alınan bir kesittir. Bazı dokular, sonuçların yorumlanmasını etkileyen arka plan boyamasına neden olan doğal özelliklere sahiptir. Örneğin, endojen floresan moleküller içeren dokular, floresan IHC boyunca pozitif boyama ile karıştırılabilir. Endojen bir arka plan olmadığından emin olmak için doku, floresan veya parlak alan aydınlatması (sırasıyla floresan veya kromojenik etiketler için) kullanılarak mikroskop altında kontrol edilmelidir.
Reaktif kontrolleri
Primer antikor olmayan kontrol
Bir primer antikor olmayan kontrol, boyamanın, primer antikor tarafından antijenin saptanmasından meydana geldiğini ve saptama sistemi veya örnek tarafından meydana getirilmediğini doğrular. Bu, numunenin primer antikor olmadan yalnızca antikor seyreltici ile inkübe edilmesini ve ardından sekonder antikorlar ve saptama reaktifleri ile inkübe edilmesini içerir.
İzotip kontrolü
Monoklonal primer antikorlarla çalışırken bir izotip kontrolü kullanılabilir ve böylelikle gözlenen boyamanın antikorun doku ile spesifik olmayan etkileşimlerinden kaynaklanıp kaynaklanmadığı kontrol edilir. Doku, antikor seyreltici ve primer antikorla aynı konsantrasyonda aynı izotipte immün olmayan bir antikor ile inkübe edilir, ardından sekonder antikorlar ve saptama reaktifleri ile inkübe edilir. Bu kontrolle gözlenen herhangi bir arka plan boyaması göz ardı edilebilir olmalı ve spesifik boyamadan farklı olmalıdır.
Absorpsiyon kontrolü
Bir absorpsiyon kontrolü, primer antikor yerine önceden absorbe edilmiş bir antikorla inkübasyon ve ardından sekonder antikorlar ve saptama reaktifleri ile inkübasyon yoluyla antikorun ilgili antijene spesifik olarak bağlandığını gösterir. Önceden absorbe edilmiş bir antikor, antikorun immünojenin büyük bir molar fazlası (10 kat) ile 4°C’de gece boyunca inkübasyonu ile üretilebilir.
İmmünojen bir peptit ise absorpsiyon kontrolleri daha güvenilirdir, çünkü antikor-protein immünojen karışımları, protein ve doku arasındaki spesifik olmayan etkileşimler nedeniyle dokularda yüksek arka plan boyamasına neden olabilir.