Nöroinflamasyonun Alzheimer hastalığının ilerlemesine katkısını inceleyin.
Alzheimer hastalığı klasik olarak, beyinde plaklar ve yumaklar oluşturan, yanlış katlanmış Aβ ve tau proteinlerin birikmesiyle karakterize edilmiştir. Bununla birlikte, ortaya çıkan kanıtlar, aktive edilmiş glial hücreler tarafından yönetilen doğal bağışıklığın ve nöroinflamasyonun Alzheimer hastalığının patogenezinde temel bir rol oynadığını göstermektedir.
Alzheimer hastalığı patolojisine katkıda bulunduğu düşünülen nöroinflamasyon mekanizmalarını keşfedin.
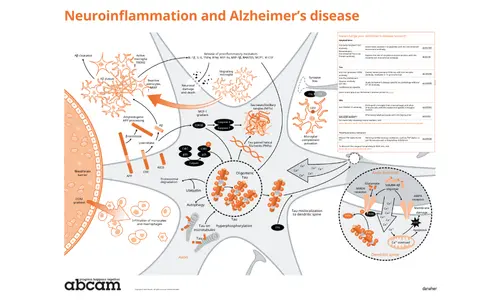
Alzheimer hastalığında nöroinflamasyona genel bakış
Araştırma topluluğu arasında genel kanı, Alzheimer hastalığının (AH) nihayetinde, yanlış katlanmış amiloid beta (Aβ) ve tau proteinlerinin birikiminden kaynaklandığıdır. Ancak Aβ/tau hipotezi, hastalığın tüm patolojisini açıklamamaktadır ve Aβ’yi hedeflemek için geliştirilen ilaçlar, hastalık sonuçlarını iyileştirmede nispeten başarısız olmuştur. 1990’lardan beri yapılan araştırmalar, nöroinflamasyonun AH’nin ilerlemesine önemli ölçüde katkıda bulunduğunu göstermektedir.
Nöroinflamasyon, beyinde bulunan doğal bağışıklık hücreleri olan mikroglia ve astrositlerin aktivasyonunu içerir. Kan-beyin bariyeri genellikle beyni iltihaplanmanın etkilerinden korur, ancak hasar (örneğin, inflamatuar türler tarafından) bariyerin daha geçirgen hale gelmesine neden olabilir ve bu da monositler ve makrofajlar gibi hücrelerin beyne girmesine olanak sağlar. Bu durum, Alzheimer hastalığının genel gidişatı gibi, nöroinflamasyonun da kendi kendini besleyen, giderek artan bir süreç olduğunu gösterir.
Alzheimer hastalığında, sürekli devam eden bir inflamatuar yanıtın olduğunu gösteren kanıtlar vardır: AH hastalarının beyinlerinde inflamatuar sinyal markerları artmıştır1 ve Aβ ve tau gibi AH markerlarının, AH hastalarının plazmasında TNF-α ve interlökinler gibi inflamatuar markerlarıyla pozitif korelasyon gösterdiği bulunmuştur2.
AH’nin inflamatuar mekanizmasının mikroglia aktivasyonu etrafında döndüğü düşünülmektedir. Aβ’nin mikrogliayı kronik olarak aktive ettiği düşünülmektedir ve kanıtlar tau agregatlarının da mikrogliayı aktive ettiğini göstermektedir3. Yoğun bir şekilde aktive oldukları normal koşullar altında, mikroglia, fagositoz yoluyla Aβ ve diğer kalıntıları temizlemede önemli bir rol oynar, ancak bu performans kronik olarak aktive edilmiş mikrogliada azalır. Bu süreç, mikroglialar üzerinde eksprese edilen ve onların amiloid plaklarına yanıtında yer alan bir protein olan TREM2 tarafından modüle edilir. TREM2’nin fonksiyon kaybı, mikroglianın amiloid plaklarını temizleme hızını azalttığı için, TREM2 varyantlarının AH semptomlarıyla ilişkili olduğu bulunmuştur4.
Mikroglia aktive edildiğinde, interlökinler ve TNF-α gibi pro-inflamatuar sitokinlerin yanı sıra reaktif oksijen türleri (ROT) üretir ve salgılar; bunların tümü normal sinaptik işleyişi bozabilir ve hücre ölümüne neden olabilir. Üretilen sitokinler ayrıca başka mikrogliaları da toplayarak bir kaskad oluşturabilir. Bu kısır döngü, pro-inflamatuar aracıların daha fazla Aβ oligomerinin yanı sıra daha fazla tau hiperfosforilasyonuna neden olmasıyla tamamlanır; bu da sırayla daha fazla mikroglial aktivasyona ve Aβ ve tau agregatlarıyla ilişkili nöronal hasar ve hücre ölümüne neden olur. Nöroinflamatuar döngü ayrıca kan-beyin bariyerine de zarar vererek süreci daha da hızlandırabilir.
Referanslar
1 Gomez-Nicola, D., Boche, D. Post-mortem analysis of neuroinflammatory changes in human Alzheimer’s disease Alzheimer’s research & therapy (7),42 (2015)
2 Foley, K., Winder, Z., Sudduth, T., et al. Alzheimer’s disease and inflammatory biomarkers positively correlate in plasma in the UK-ADRC cohort Alzheimer’s and dementia 20 (2),1374-1386 (2023)
3 Morales, I., Jimenez, J. M., Mancilla, M., Maccioni, R. B. Tau oligomers and fibrils induce activation of microglial cells Journal of Alzheimer’s disease 37 (4),849-856 (2013)
4 Shi, Y., Holtzman, D. Interplay between innate immunity and Alzheimer’s disease: APOE and TREM2 in the spotlight Nature Reviews Immunology (18),759-772 (2018)
Yazının orijinali buradan alınmıştır.